Articlé publié dans: Ramus, F. (2018). Les surdoués ont-ils un cerveau qualitativement différent? A.N.A.E., 30(154), 281‑287.
Parmi les mythes et légendes qui entourent les surdoués, l’un des plus répandus concerne l’idée d’un mode de fonctionnement qualitativement différent : spécificités du traitement de l’information, pensée en arborescence, hypersensibilité, hyperesthésie (Revol, Louis, & Fourneret, 2004; Siaud-Facchin, 2010)… Lorsque l’on remarque que de telles particularités ne sont pas étayées par les études portant sur une population représentative et évitant ainsi un biais de sélection en faveur des seuls surdoués ayant des problèmes (Ramus & Gauvrit, 2017), la réplique consiste souvent à renvoyer l’arbitrage aux neurosciences : le fonctionnement différent des surdoués serait révélé par des caractéristiques cérébrales qualitativement différentes : Hyperactivation cérébrale, plus grande vitesse de transmission, hyperconnectivité, implication plus grande de l’hémisphère droit, vulnérabilité de l’amygdale (Fumeaux & Revol, 2012; Siaud-Facchin, 2010)… L’objet du présent article est de passer en revue les études de neuroimagerie pertinentes, afin de déterminer s’il existe ou pas des données à l’appui de l’idée d’un cerveau qualitativement différent chez les surdoués.
Il existe une immense littérature sur les bases cérébrales de l’intelligence (Deary, Penke, & Johnson, 2010), qu’il n’est pas possible de passer exhaustivement en revue ici. Nous nous bornerons donc à rapporter un nombre limité d’études illustrant bien les résultats obtenus dans ce domaine. Ces études recherchent de manière générale des corrélats cérébraux de l’intelligence générale, c’est-à-dire plus spécifiquement des mesures cérébrales quantitatives (fonctionnelles ou anatomiques) qui sont corrélées avec le quotient intellectuel (QI).
Bien que la plupart de ces études ne s’attachent pas spécifiquement à déterminer les bases cérébrales du haut QI (HQI), l’existence de corrélations entre propriétés cérébrales et QI implique que, si l’on isole les individus avec le QI le plus élevé dans un groupe, et le reste de la population dans un autre groupe, une comparaison statistique entre les deux groupes va immanquablement révéler des différences significatives, à partir du moment où l’effectif est suffisant. C’est ce qu’ont pu constater quelques études consacrées spécifiquement au HQI.
Bien que le second type d’études semble plus directement pertinent pour déterminer les caractéristiques cérébrales des HQI, les deux types convergent naturellement vers les mêmes résultats, car le groupe HQI se situe simplement à un extrême du continuum de l’intelligence générale, et des propriétés cérébrales correspondantes. Les deux types d’études sont d’ailleurs cités indifféremment par les tenants d’un cerveau qualitativement différent (Fumeaux & Revol, 2012). Commençons par examiner les études qui comparent deux groupes en fonction du niveau de QI.
Comparaisons entre groupes de QI élevé et normal
Une étude coréenne comparant 18 adolescents à haut QI et 18 adolescents à QI normal illustre bien les résultats obtenus en imagerie fonctionnelle (Lee et al., 2006). Dans cette étude, les participants devaient résoudre, dans l’IRM, différents tests d’intelligence (basés sur les matrices de Raven). L’analyse a donc porté sur les régions cérébrales activées pendant la résolution de tels tests, et dont les activations différaient entre les deux groupes. Un résumé des résultats est montré en Figure 1, mettant en évidence deux grands ensembles de régions, dans le cortex préfrontal et dans le cortex pariétal postérieur, régions qui sont significativement plus activées par le groupe HQI. Remarquons au passage que l’hypothèse d’une implication supérieure de l’hémisphère droit chez les HQI n’est pas confirmée par ces données, qui sont rigoureusement symétriques.

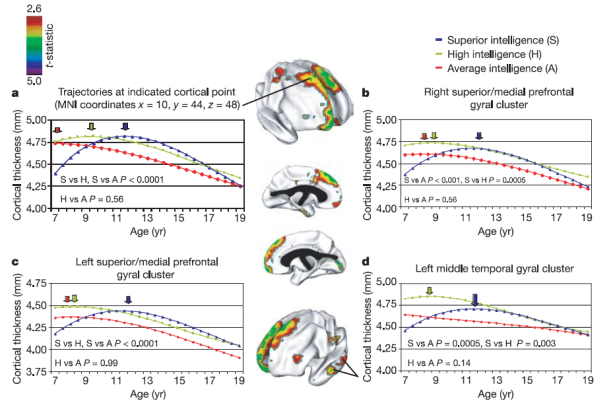
Une autre étude remarquable a analysé l’épaisseur du cortex, et l’évolution de cette épaisseur au cours du développement (de 7 à 19 ans), chez trois groupes d’enfants, à QI moyen, élevé, et supérieur (Shaw et al., 2006). La Figure 2 illustre les trajectoires d’épaisseur corticale des trois groupes dans quelques régions particulières, frontales et temporales gauche et droite. Les résultats montrent que l’épaisseur du cortex n’est pas constante au cours de la vie, mais qu’elle croît au cours de l’enfance, atteint un pic, puis décroît au cours de l’adolescence (puis de la vie adulte). La trajectoire précise dépend à la fois de la région du cortex, et du niveau de QI de l’enfant. Contrairement à l’intuition qui voudrait que les enfants les plus intelligents, étant intellectuellement précoces, connaissent un développement cérébral accéléré, il s’avère que ce sont ceux qui connaissent la maturation de l’épaisseur corticale la plus tardive. La signification fonctionnelle précise de ces variations d’épaisseur corticale reste à ce jour ouverte.
Enfin, mentionnons une étude française récente qui a comparé les propriétés de la matière blanche entre trois groupes d’enfants: QI normal, HQI selon les critères usuels (QI total >130), et un groupe d’enfants dits « HQI hétérogènes », sélectionnés sur la base d’un indice de compréhension verbale supérieur à 130, et supérieur d’au moins 15 points à l’indice de raisonnement perceptif (Nusbaum et al., 2017). Les résultats obtenus sont compatibles avec l’idée d’une meilleure connectivité de la matière blanche chez les HQI, à la fois au sein de chaque hémisphère et entre les hémisphères.
En revanche, les résultats de la comparaison entre HQI homogènes et hétérogènes sont plus difficiles à interpréter, dans la mesure où les HQI hétérogènes avaient en moyenne 10 points de QI total de moins par rapport aux HQI homogènes, et où l’on ne sait pas si les différences attribuées à l’hétérogénéité du QI sont spécifiques au HQI ou si elles se retrouveraient aussi bien à des QI moyens ou faibles et hétérogènes.
Les comparaisons de groupes, surtout lorsqu’elles sont illustrées par des graphiques en barre montrant seulement les moyennes de chaque groupe comme dans la Figure 1, pourraient laisser croire à des différences cérébrales qualitatives entre groupes de HQI et QI normaux. Mais il faut être conscient que ces comparaisons statistiques de groupes et ces diagrammes en barres masquent les données individuelles, et en particulier ne renseignent pas sur le recouvrement des caractéristiques cérébrales entre les deux groupes, qui peut très bien être important. C’est pour cela qu’il est nécessaire d’examiner les études qui montrent les données individuelles, ce que nous allons faire dans le cas des études de corrélation entre QI et caractéristiques cérébrales.
Corrélations entre QI et propriétés cérébrales
Caractéristiques cérébrales fonctionnelles
Parmi les nombreux corrélats cérébraux fonctionnels du QI, on peut citer l’activation des régions préfrontales et pariétales postérieures, qui est d’autant plus grande que le QI est élevé (Duncan et al., 2000; Jung & Haier, 2007; Lee et al., 2006). De plus, la connectivité fonctionnelle (la capacité de différentes régions à communiquer entre elles) semble d’autant plus élevée que le QI est élevé, en particulier entre les régions frontales et pariétales (Song et al., 2008) (mais une étude à grande échelle vient d’échouer à répliquer ce résultat: Kruschwitz, Waller, Daedelow, Walter, & Veer, 2018).
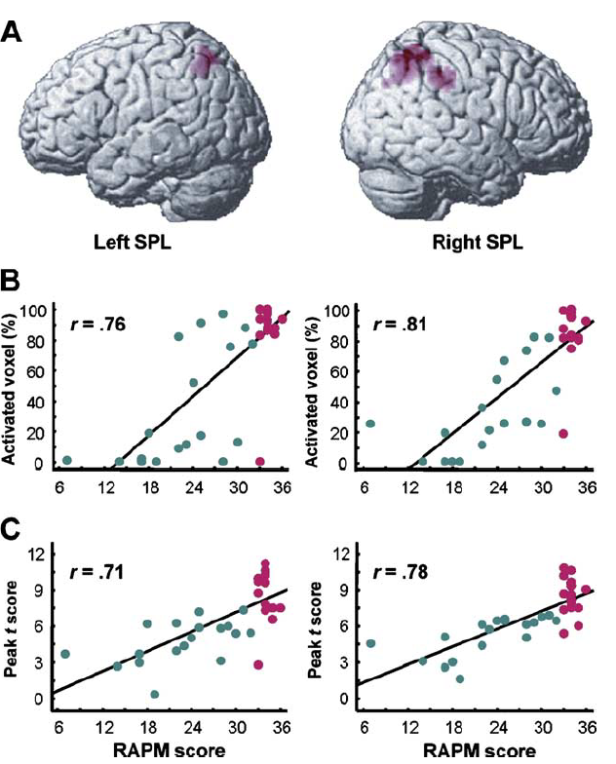
Ces résultats sont tout à fait compatibles avec les comparaisons de groupes évoquées à la section précédente. De fait, on y retrouve l’étude coréenne de Lee et al. (2006), qui a à la fois analysé les corrélations entre QI et activations cérébrales, et comparé les groupes en fonction du QI. Cette étude a l’intérêt supplémentaire de fournir des graphes montrant des données individuelles, et permettant de comprendre précisément en quoi les individus avec HQI diffèrent des autres. La Figure 3 représente les mêmes données que le bas de la Figure 1, mais permet cette fois d’observer les caractéristiques cérébrales individuelles des participants avec HQI (en mauve) et de ceux avec QI normal (en vert). Elle permet de faire les observations suivantes :
- De même que les HQI se situent à un extrême du continuum des scores de QI, ils se situent en moyenne à un extrême du continuum des activations du cortex pariétal postérieur.
- Néanmoins, il y a recouvrement entre les deux groupes (sur l’axe des ordonnées, représentant les activations cérébrales) : certains individus avec HQI n’ont pas des activations extrêmes. Certains individus avec QI normal ont des activations aussi élevées que les HQI.
- Globalement, le groupe HQI est dans la continuité de la corrélation entre QI et activation cérébrale, il ne se détache pas particulièrement des autres sur cette caractéristique cérébrale particulière. On ne peut donc pas dire que les activations cérébrales des HQI soient qualitativement différentes.
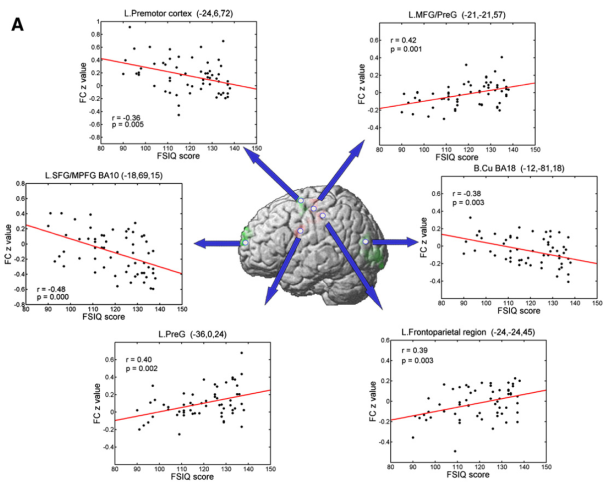
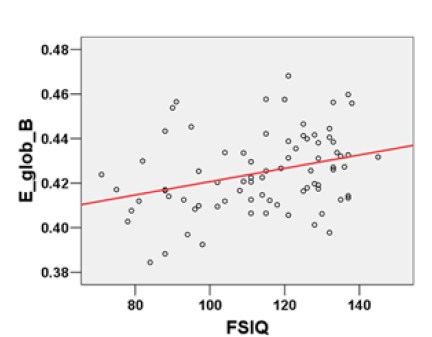
Concernant la connectivité fonctionnelle, l’article de Song et al. (2008) montre des résultats similaires. La Figure 4 montre que la connectivité fonctionnelle entre le cortex dorso-latéral préfrontal gauche et chaque région indiquée est corrélée avec le QI, positivement pour certaines régions, négativement pour d’autres. Dans un cas comme dans l’autre, les individus HQI, que l’on peut identifier comme les points à droite de la valeur FSIQ=130, ont en moyenne des valeurs extrêmes de connectivité fonctionnelle. Mais ils ne sont de toute évidence pas qualitativement différents des autres.
Caractéristiques cérébrales anatomiques
Si l’on examine cette fois les caractéristiques cérébrales anatomiques associées au QI, la plus connue depuis le plus longtemps est tout simplement le volume total du cerveau: plus le cerveau est gros, plus le QI de l’individu est élevé. Ce résultat a été répliqué dans des dizaines d’études portant sur des milliers de participants, et ce quelle que soit la mesure cérébrale : volume total, volume de matière grise ou blanche, volume intracrânien, et même le périmètre crânien. En revanche, le volume cérébral ne détermine pas à lui tout seul le QI, loin s’en faut. Dans la méta-analyse la plus récente, la corrélation n’est que de 0.24 (Pietschnig, Penke, Wicherts, Zeiler, & Voracek, 2015). Par conséquent, les personnes HQI ont, en moyenne, un cerveau un peu plus volumineux que les personnes à QI normal, mais à nouveau avec un large recouvrement entre les deux groupes (ce qui est donc compatible avec les exceptions les plus connues, comme Albert Einstein et Anatole France, dont le cerveau était plus petit que la moyenne, et en supposant qu’elles étaient vraiment surdouées comme le voudrait la légende).
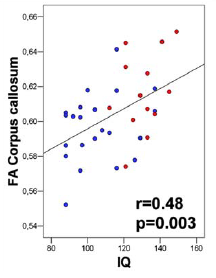
La connectivité fonctionnelle, mentionnée à la section précédente, a des bases anatomiques mesurables par les techniques d’imagerie de diffusion à l’IRM. Dans ce domaine également, les études montrent une corrélation positive entre le QI et les mesures de connectivité anatomique, en particulier en ce qui concerne le corps calleux connectant les deux hémisphères (Clayden et al., 2012; Navas-Sánchez et al., 2014). Elles sont donc compatibles avec l’idée que les personnes HQI ont une meilleure connectivité inter-hémisphérique. Là encore, l’examen des données individuelles de l’étude de Navas-Sánchez et al. (2014) est instructif (Figure 5), montrant que les HQI sont juste dans la continuité du reste de la population.
Une autre étude a utilisé les outils mathématiques de la théorie des graphes afin de calculer de multiples mesures de la connectivité globale du cerveau (Li et al., 2009). Cette étude a trouvé de nombreuses corrélations entre QI et diverses mesures de connectivité. La Figure 6 en illustre une, concernant la mesure dite d’efficacité globale, qui montre encore une fois que les personnes avec un QI supérieur à 130 ont en moyenne une efficacité globale légèrement supérieure, mais pas qualitativement différente de celle du reste de la population. L’article de Li et al. contient 12 autres figures qui conduisent à la même conclusion.
On pourrait encore multiplier les exemples avec diverses caractéristiques cérébrales corrélées au QI. Il n’existe à notre connaissance aucune propriété cérébrale qui serait spécifique aux HQI, ou qui montrerait une discontinuité entre les HQI et les QI normaux.
Un dernier point qui a nécessité une vérification particulière est le cas particulier de l’amygdale, une petite structure impliquée dans le traitement des émotions et parfois réputée être plus vulnérable chez les surdoués (Siaud-Facchin, 2010). Aucune des études que nous avons mentionnées dans cet article n’a rapporté la moindre différence entre HQI et QI normal dans l’amygdale, ni de corrélation entre une caractéristique de l’amygdale et le QI. Une recherche spécifique dans les bases de données bibliographiques a permis de faire émerger une étude portant sur les corrélats cérébraux du QI et examinant spécifiquement deux structures sous-corticales : l’hippocampe et l’amygdale. Cette étude rapporte des corrélations négatives entre le volume de l’hippocampe et le QI, mais pas la moindre corrélation entre volume ou surface de l’amygdale et QI (Amat et al., 2008).
Conclusion
Les individus à HQI semblent se caractériser par les propriétés cérébrales suivantes :
- plus grande activation de régions préfrontales et pariétales postérieures ;
- plus grande connectivité fonctionnelle et anatomique, particulièrement entre les deux hémisphères ;
- un cerveau plus volumineux ;
Certaines études ont également rapporté (avec un niveau de preuve moindre) :
- une trajectoire développementale plus tardive de l’épaisseur du cortex dans un certain nombre de régions ;
- un hippocampe de moindre volume (relativement au volume cérébral total).
En revanche, nous n’avons trouvé aucune donnée venant à l’appui d’une implication plus grande de l’hémisphère droit, ni d’une vulnérabilité particulière de l’amygdale.
Dans tous les cas, il s’agit de différences statistiques entre groupes HQI et QI normal, ou de corrélations entre le QI et la caractéristique cérébrale correspondante. A partir du moment où il y a des corrélations entre le QI et certaines caractéristiques cérébrales, le fait que certaines personnes ayant des QI extrêmes obtiennent également des valeurs extrêmes dans les caractéristiques cérébrales corrélées est une nécessité logique. Il ne s’ensuit pas que les HQI auraient un cerveau qualitativement différent : ils se situent juste dans le prolongement de la corrélation, sans aucune discontinuité apparente. Dans toutes les études que nous avons examinées, les caractéristiques cérébrales des HQI se recouvrent avec celles des individus à QI normal : d’une part, certains individus avec HQI n’ont pas des caractéristiques cérébrales extrêmes ; d’autre part, certains individus avec QI normal ont des caractéristiques cérébrales aussi extrêmes que les HQI moyens.
Finalement, tout ce que permettent de conclure les études de neuroimagerie sur le HQI, c’est que de même que ces personnes ont des fonctions cognitives plus performantes que les autres, elles ont, comme on pourrait s’y attendre, des fonctions cérébrales (en moyenne) plus performantes que les autres.
Références
Amat, J. A., Bansal, R., Whiteman, R., Haggerty, R., Royal, J., & Peterson, B. S. (2008). Correlates of intellectual ability with morphology of the hippocampus and amygdala in healthy adults. Brain and Cognition, 66(2), 105‑114. https://doi.org/10.1016/j.bandc.2007.05.009
Clayden, J. D., Jentschke, S., Muñoz, M., Cooper, J. M., Chadwick, M. J., Banks, T., … Vargha-Khadem, F. (2012). Normative Development of White Matter Tracts: Similarities and Differences in Relation to Age, Gender, and Intelligence. Cerebral Cortex, 22(8), 1738‑1747. https://doi.org/10.1093/cercor/bhr243
Deary, I. J., Penke, L., & Johnson, W. (2010). The neuroscience of human intelligence differences. Nature Reviews Neuroscience, 11(3), 201‑211. https://doi.org/10.1038/nrn2793
Duncan, J., Seitz, R. J., Kolodny, J., Bor, D., Herzog, H., Ahmed, A., … Emslie, H. (2000). A Neural Basis for General Intelligence. Science, 289(5478), 457‑460. https://doi.org/10.1126/science.289.5478.457
Fumeaux, P., & Revol, O. (2012). Le haut potentiel intellectuel: mythe ou réalité? Revue de santé scolaire et universitaire, 18, 8–10.
Jung, R. E., & Haier, R. J. (2007). The Parieto-Frontal Integration Theory (P-FIT) of intelligence: Converging neuroimaging evidence. Behavioral and Brain Sciences, 30(2), 135‑154. https://doi.org/10.1017/S0140525X07001185
Kruschwitz, J. D., Waller, L., Daedelow, L. S., Walter, H., & Veer, I. M. (2018). General, crystallized and fluid intelligence are not associated with functional global network efficiency: A replication study with the human connectome project 1200 data set. NeuroImage. https://doi.org/10.1016/j.neuroimage.2018.01.018
Lee, K. H., Choi, Y. Y., Gray, J. R., Cho, S. H., Chae, J.-H., Lee, S., & Kim, K. (2006). Neural correlates of superior intelligence: Stronger recruitment of posterior parietal cortex. NeuroImage, 29(2), 578‑586. https://doi.org/10.1016/j.neuroimage.2005.07.036
Li, Y., Liu, Y., Li, J., Qin, W., Li, K., Yu, C., & Jiang, T. (2009). Brain Anatomical Network and Intelligence. PLOS Computational Biology, 5(5), e1000395. https://doi.org/10.1371/journal.pcbi.1000395
Navas-Sánchez, F. J., Alemán-Gómez, Y., Sánchez-Gonzalez, J., Guzmán-De-Villoria, J. A., Franco, C., Robles, O., … Desco, M. (2014). White matter microstructure correlates of mathematical giftedness and intelligence quotient. Human Brain Mapping, 35(6), 2619‑2631. https://doi.org/10.1002/hbm.22355
Nusbaum, F., Hannoun, S., Kocevar, G., Stamile, C., Fourneret, P., Revol, O., & Sappey-Marinier, D. (2017). Hemispheric Differences in White Matter Microstructure between Two Profiles of Children with High Intelligence Quotient vs. Controls: A Tract-Based Spatial Statistics Study. Frontiers in Neuroscience, 11. https://doi.org/10.3389/fnins.2017.00173
Pietschnig, J., Penke, L., Wicherts, J. M., Zeiler, M., & Voracek, M. (2015). Meta-analysis of associations between human brain volume and intelligence differences: How strong are they and what do they mean? Neuroscience & Biobehavioral Reviews, 57, 411‑432. https://doi.org/10.1016/j.neubiorev.2015.09.017
Ramus, F., & Gauvrit, N. (2017). La légende noire des surdoués. La Recherche, Mars 2017. Consulté à l’adresse Florilège : https://ramus-meninges.fr/la-pseudoscience-des-surdoues/#florilege
Revol, O., Louis, J., & Fourneret, P. (2004). L’enfant précoce : signes particuliers. Neuropsychiatrie de l’Enfance et de l’Adolescence, 52(3), 148‑153. https://doi.org/10.1016/j.neurenf.2003.10.004
Shaw, P., Greenstein, D., Lerch, J., Clasen, L., Lenroot, R., Gogtay, N., … Giedd, J. (2006). Intellectual ability and cortical development in children and adolescents. Nature, 440, 676‑679.
Siaud-Facchin, J. (2010). Quand l’intelligence élevée fragilise la construction de l’identité : comment grandit-on quand on est surdoué ? Développements, (6), 35‑42.
Song, M., Zhou, Y., Li, J., Liu, Y., Tian, L., Yu, C., & Jiang, T. (2008). Brain spontaneous functional connectivity and intelligence. NeuroImage, 41(3), 1168‑1176. https://doi.org/10.1016/j.neuroimage.2008.02.036
Bonjour,
Si je comprends bien votre conclusion et en la traduisant en mécanique :
les voitures allant le plus vite ont des moteurs plus efficaces mais des plus lentes aux plus rapides toutes les voitures ont des moteurs thermiques, aucune n’est équipée de réacteur à fusion.
Finalement, d’après-vous, la recherche de la validation d’un fonctionnement qualitativement différent des cerveaux des HQI n’est-elle pas liée à une volonté de démontrer l’origine innée des HQI voir plus généralement du QI ?
Bonne fin de journée
J’aimeJ’aime
Votre analogie me parait correcte.
En revanche, je ne crois pas que la question de l’inné et de l’acquis soit la motivation principale derrière le mythe d’un fonctionnement qualitativement différent. J’ai l’impression que cela vient essentiellement de l’introspection de certaines personnes qui ont l’impression de fonctionner différemment des autres (mais que savent-elles du fonctionnement des autres, bien sûr!).
Il existe par ailleurs des données bien plus directe concernant la part de facteurs génétiques et autres impliqués dans l’intelligence générale. Voyez par exemple: http://www.lscp.net/persons/ramus/docs/C&P12intelligence.pdf
J’aimeJ’aime
Bonjour, et merci encore une fois pour cet article.
Au sujet d’Einstein, il y a quelque chose qui ne colle pas avec la légende. D’ailleurs, la légende sur les surdoués étaie un fonctionnement cérébral différent.
Einstein a du faire preuve de beaucoup de persévérance, et s’est entouré, pour établir la théorie de la relativité générale: cela a pris 8 ans. C’est génial, mais ce n’est pas un éclair de génie.
J’aimeJ’aime
Bonjour et merci pour vos articles sur le sujet de la douance.
C’est en écoutant une « spécialiste » sur le sujet qui parlait de Winston Churchill comme d’un surdoué (que je sache il n’a jamais été testé) que je me suis intéressé aux études « sérieuses » ou pas en la matière. Je ne suis pas du tout surdoué, mais je crois que le problème dans tous ces débats est dû au fait qu’un HPI est pour certains clinitiens un hypersensible cogitant à longueur de journée; et je pourrais, par exemple, très bien m’identifier dans ce cas, hors une simple tentative de réussir le pré-test de Mensa prouve sans aucun doute que j’ai un QI normal, ou faible, mais en aucun cas très supérieur à la moyenne. Pouvez-vous aujourd’hui me confirmer qu’aucune étude ne démontre une plus grande sur excitabilité des HPI par rapport à des QI moyens.
Merci de votre attention.
J’aimeJ’aime
Le point sur le différentiel dans le développement de l’épaisseur du cortex – avec un apex à 13 ans au lieu de 7 ans – s’inscrit dans un phénomène bien connu de mesure de grandeurs physiques absolues (et non de mesures relatives comme l’intelligence) : taille des personnes, âge de la proprioception, de la marche etc. Il s’agit donc d’un constat particulièrement intéressant en termes de validation de la réalité physique de la mesure de l’intelligence (critiques de Turkheimer) puisque la réalité statistique et sociale est suffisamment établie (Linda Gottfredson, Bouchard etc).
J’aimeJ’aime
Je ne sais pas si je comprends bien ce commentaire. Bien sûr les mesures absolues et relatives ne sont pas la même chose, mais elles sont néanmoins convertibles les unes en les autres.
Les scores de QI sont relatifs (à la population de même âge), mais ils sont calculés à partir de scores bruts qui, eux, sont absolus. Et qui atteignent un maximum entre 20 et 25 ans (pas identique pour tous les tests, avec le vocabulaire qui tend à croître pendant bien plus longtemps).
Symétriquement, les mesures d’épaisseur de cortex sont absolues, mais en partant d’une grande population on pourrait facilement en faire une norme (de l’épaisseur elle-même, ou bien de l’âge auquel le maximum est atteint), et du coup situer chacun relativement à cette norme.
J’aimeJ’aime
Bonjour,
Je suis très heureuse d’avoir pu mettre la main sur cet article, car il présente des données que je recherchais depuis longtemps.
Avant toute chose, j’ose proposer une hypothèse concernant les caractéristiques qui se recouvrent (certains sujets à QI normal ayant des fonctionnements cérébraux identiques à des sujets à HQI et inversement) : peut-être est-ce dû à une erreur diagnostique? Je consulte régulièrement un blog dédié au HPI (Overthe130) dont l’auteure, étudiante en psychologie, souhaite se spécialiser dans le domaine du HPI, et qui rapporte les bilans de ses formations au WAIS (entre autre). Le formateur qu’elle a pu rencontrer, spécialiste des tests psychométriques, l’a informée que les notions de HQI et de HPI ne se recouvraient pas, et que l’on pouvait être HQI sans être HPI, et inversement (une étude avait même montré que sur une cohorte de 100 enfants intellectuellement précoces retestés à l’âge adulte, presque un tiers d’entre eux n’était « plus » HPI). Apparemment, toujours selon ce formateur, un HPI se détecte conjointement avec un score total relativement élevé (supérieur à très supérieur), et une répartition des scores telle que l’ICV et l’IRP soient supérieurs à l’IMT et l’IVT (ainsi que l’analyse de l’anamnèse). Donc serait-il envisageable de penser que les recouvrements observés au sein des études soient dû à des erreurs diagnostiques, si le seul critère retenu était le QIT, sans analyse des scores (ni de l’anamnèse)?
Je me demande si les personnes HPI, qu’elles aient ou non obtenu un score total > 130, ont réellement des particularités cérébrales qualitativement différentes. Si ce n’est pas le cas, pourquoi s’être donné la peine de définir le HPI, et de le différencier du HQI? Et de la même façon qu’on peut avoir un QI plus ou moins élevé, peut-on être plus ou moins HPI? Je voyais le HPI d’une façon similaire au diabète : soit on l’est, soit on ne l’est pas, même s’il existe des situations plus graves que d’autres. (Et je en veux pas dire par là que le HPI est une maladie, ou est handicapant!) Qu’est-ce que le HPI, alors? Un autre seuil statistique? (Alors que cette notion a émergé précisément pour se débarrasser du seuil des 130, qui pouvait n’avoir aucun sens dans pas mal de cas.)
J’espère que vous pourrez m’apporter quelques éclaircissements.
Bien à vous,
Laura
J’aimeJ’aime
Bonjour,
Comment s’inscrivent les résultats de cette étude (dont je ne trouve pas l’article dédié) par rapport à votre article ?
http://www.ra-sante.com/enfant-precoce-etude-cerveau-lyon-121798.html?fbclid=IwAR2V2ViR4dmiNvdBjb_SAUF7lPNCUENuNkYDYjT-xrl16L3HJtpxGEPqGc0
Merci
J’aimeJ’aime
Il doit s’agir de l’article de Nusbaum et al. (2017) que je commente plus haut. Mais les interprétations dans ce compte-rendu vont bien au-delà des résultats de l’étude.
J’aimeJ’aime
Effectivement c’est bien cet article !
Merci pour votre réponse (et pour ce que vous présentez ici, c’est fort instructif et intéressant).
J’aimeJ’aime
Concernant l’étude de Nusbaum et al, comment peuvent ils à partir d’IRM, qui certes montrent des activations différentes dans le cerveau selon les profils, déduire que les uns sont plus anxieux, plus inadaptés ou je ne sais quoi d’autre? Ce n’est vraiment pas sérieux d’extrapoler de la sorte, de plus dans les profils hétérogènes il y a une différence entre ceux qui ont un trouble type dys, TDA/H ou autre et ceux qui n’ont n’en pas.Par conséquent comment expliquer l’hétérogénéité chez ces derniers: lire l’article de Grégoire et Labouret et même tout le numéro 154 de la revue ANAE certains devraient vraiment le lire et le relire.
J’aimeJ’aime
L’étude de Nusbaum ne dit rien de tout cela. C’est peut-être dans les médias que certains font dire à cette étude des choses qu’elle ne dit pas.
J’aimeJ’aime
Franck Ramus je pense avoir assez d’esprit critique pour ne pas gober sans vérifications ce que les médias diffusent, je porte un soin particulier aux sources d’ou ma présence sur votre blog. Les propos que je rapporte dans mon commentaire précédent sont bien ceux de Nusbaum dans son interview avec le docteur Sappey-Marinier concernant cette étude sur les profils HQI laminaires et complexes et c’est bien ce qui me déçoit. Par ailleurs cette études apporte des éléments intéressants qui ne devraient pas être gâchés par des interprétations abusives. Merci pour votre disponibilité et votre travail.
J’aimeJ’aime
Bonjour M. Ramus,
La lecture de votre blog et des articles qui y sont commentés ou publiés est toujours très intéressante. En l’occurrence je me pose une question peut-être quelque peu « technique », en termes d’interprétations d’études en particulier celles résumées ici, que je n’ai pas encore consultées en elles-mêmes.
Par exemple, en relatant les conclusions possibles de l’étude de Song et al. 2018, sur la connectivité fonctionnelle de structures cérébrales chez les HQI et sujets normaux évalués, l’affirmation tombe ensuite : » les individus HQI ont en moyenne des valeurs de connectivité extrèmes, mais de toute évidence pas un fonctionnement qualitativement différent ».
Cette affirmation, dont je ne conteste pas la validité au demeurant, est avec d’autres arguments (merci pour leur partage au passage 🙂 ) anatomiques/physiologiques, excusez le raccourci éhonté, issue a priori de l’analyse des études consultées et cette affirmation d’absence de différence évidente de fonctionnement cérébral est donc réitérée à plusieurs reprises en plusieurs endroits en tant que conclusion partielle quant aux résultats des études dignes de foi citées.
Ma question de novice en la matière, est de savoir plus précisément en termes d’interprétations, comment peut-on savoir cela de fait avec ces données (au sens d’interprétation issue des statistiques montrées ? C’est-à-dire, est-ce par l’absence de discontinuité manifeste dans ces données illustrées par exemple en figure 4 et 6 que l’on peut affirmer que le fonctionnement cérébral n’est guère qualitativement différent ?
Merci encore de vos précisions, et le meilleur pour vous.
J’aimeJ’aime
Effectivement, l’affirmation de l’absence de différence qualitative repose sur l’absence de discontinuité dans toutes les mesures connues: cognitives, cérébrales fonctionnelles et anatomiques. Si les surdoués étaient qualitativement différents dans une quelconque caractéristique, eh bien en mesurant correctement cette caractéristique on devrait bien voir une discontinuité. Peut-être qu’on n’a pas encore trouvé la bonne caractéristique discontinue, ou qu’on ne sait pas bien la mesurer. Mais en tous cas, toutes les caractéristiques qui ont été proposées et mesurées jusqu’à présent ne vérifient pas cette propriété.
J’aimeJ’aime
Le ciel du haut potentiel « s’éclaircit » un peu plus chaque jour. Mme Rixain, consultante en communication, et Mme Meunier, avocate, ont fait récemment la « lumière » sur le sujet (cf. lien), en tant que députées : hypersensibilité, sens aigu de la justice, phobie scolaire, décrochage, dysharmonie etc. etc. Tous les stéréotypes y passent. Et elles veulent que soit largement enseigner cette pseudo-science. C’est génial, on progresse de plus en plus sur le sujet !
Cliquer pour accéder à Communication+Mission+Flash+Pr%C3%A9cocit%C3%A9.pdf
J’aimeJ’aime
Ironie de l’histoire, oui. Certains écrivent même « on avance ! » et sont ravis…
On peut lire dans ce rapport que
« En maths, ils savent toujours trouver la bonne réponse mais peineront à expliquer comment ils y sont parvenus. » !!!!!
« des qualités intellectuelles exceptionnelles peuvent constituer un désavantage dans le système scolaire. »!!!!
« doivent bénéficier d’une adaptation de l’organisation scolaire en fonction de leur situation, tels les enfants en situation de handicap »!!!!
« collège Janson‐de‐Sailly,… 10 élèves par niveau – soit une quarantaine au total –, qui présentent un diagnostic avéré de précocité et des troubles associés… les élèves précoces
disposent d’un local qui leur est réservé et ouvert sur tout le temps
scolaire. Ils y sont accueillis par un adulte référent. Ce local constitue
un lieu d’écoute et d’accompagnement, mais aussi un sas de
décompression. Une aide aux devoirs peut y être proposée et des
jeux sont à disposition. Chaque enfant précoce peut y inviter un
camarade non précoce, l’objectif étant de favoriser la sociabilité. »
« !!!!!
Nous avons écrit à ces députées, au nom de l’association AFEAAS, pour exprimer nos craintes de discrimination et de pathologisation/médicalisation du haut potentiel.
Voici la seule réponse que nous ayons eue :
« je n’adhère en aucune manière à vos commentaires qui ne reflètent pas la réalité de notre travail »
Gabriel Wahl a également écrit une lettre ouverte que nous avons publiée
http://les-hauts-talents.fr/lettre-ouverte-de-gabriel-wahl
Le grand risque est de désigner du doigt « les surdoués » dans les écoles et collèges, avec leur « salle de repos » ; de les mettre à l’écart ; comme si ces enfants n’étaient pas déjà suffisamment discriminés en étant harcelés et traités « d’intellos » par les autres enfants.
J’aimeJ’aime
Je ne comprends pas l’exercice qui consiste à confier à des non spécialistes la mission, ultra flash visiblement, de faire le point sur les savoirs actuels dans un domaine qu’elles ne maîtrisent absolument pas, afin de faire des recommandations de formation à un niveau national. On questionne souvent l’efficacité de l’état. Si c’est la même chose dans tous les domaines, je vois des marges d’économie colossales.
J’aimeJ’aime
De ce que j’ai pu comprendre, ces deux députées se sentaient concernées par le sujet et avaient déjà des idées assez arrêtées dessus, elles ont elles-mêmes soulevé la question des surdoués à la commission des affaires sociales, ont demandé la création de cette mission flash absolument indispensable et urgente, qui leur a bien sûr été confiée, puisqu’elles étaient concernées par le sujet. CQFD.
A partir de là, elles ont auditionné les gens qui étaient à la source des informations qu’elles avaient déjà, et d’autres de proche en proche. Il s’en est fallu d’un cheveu pour qu’elles n’auditionnent aucun scientifique! (et elle ne m’ont pas trouvé toutes seules, c’est moi qui leur ai signalé qu’il y avait peut-être des données scientifiques dont il serait utile de prendre connaissance). Mais inclure ce que je leur ai dit ne cadrait visiblement pas dans le plan pré-établi de leur rapport.
J’aimeJ’aime
Cela interroge le fonctionnement de notre démocratie : comment servir l’intérêt général sans un passage obligé par les experts d’un domaine pour faire des recommandations en termes de bonnes pratiques ? Comment se fait-il que des personnes, qui s’auto-proclament spécialistes, quasi s’auto-missionnent pour faire la « vérité » dans un domaine qu’elles connaissent si peu, et en prétendant le faire aussi vite ? Pour ce qui concerne l’Education nationale, ne serait-ce pas plutôt le rôle du conseil scientifique de l’EN de faire des recommandations en termes de HPI plutôt qu’une consultante en communication et une avocate, ou une fabricante de mythes comme Siaud-Facchin ? Il faudrait, à l’instar de Gérald Bronner, faire un grand appel à un élan de rationalité dans le domaine public !
J’aimeJ’aime
@PsyEN, c’est très inquiétant. lisez cet article récent :
« Sur le plan intellectuel, l’enfant surdoué se distingue par la forme particulière de son intelligence. « La différence est qualitative, et non quantitative comme on pourrait le penser », souligne Jeanne Siaud-Facchin. »
l’article :
https://www.psychologies.com/Famille/Enfants/Apprentissage/Articles-et-Dossiers/Enfant-precoce-surdoue-faire-de-sa-difference-une-richesse
J’aimeJ’aime
Qu’un magazine grand public, y compris intitulé « Psychologies », se fasse berner par la gourou Siaud-Facchin, c’est une chose (on voit que la journaliste ne maîtrise pas son sujet et dit beaucoup de bêtises), mais que la même gourou serve de référence à l’éducation nationale, c’est très inquiétant. Et multiplier des missions par des béotiens avec pour résultat de mettre la puissance publique au service de l’ignorance, c’est encore plus inquiétant.
J’aimeJ’aime
Bonjour
Deux ans après, nous en sommes toujours au même point.
ET quatre ans après qu’a été écrit l’article La pseudoscience des surdoués.
Jeanne Siaud-Facchin continue dans la désinformation, toujours et toujours, s’appuyant sur le fait qu’elle a participé aux travaux du ministère Pourquoi ? Mystère.
Actuellement, elle participe à introduire de fausses idées sur le haut potentiel, via une série tv sur TF1.
Quelques bribes au hasard d’un article :
« supérieur à 130, la personne est ce qu’on appelle aussi parfois « surdouée ». »
Faut-il en rire ?
« L’émotion, chez un surdoué, s’insinue partout, tout le temps, dans les moindres interstices, confirme Jeanne Siaud-Facchin. Sa réceptivité émotionnelle est incontrôlable par la raison, car sa puissance déconnecte les circuits cérébraux du contrôle. »
L’article cite un blog les tribulations d’un zèbre, qui a participé aussi à introduire de fausses idées sur le haut potentiel et qui a révélé en fait (un peu tard) que le zèbre en question était « aspie » (asperger). Ainsi, toutes les caractéristiques problématiques étaient dues à des traits autistiques.
Confusion.
Désinformation totale pour tous les lecteurs et pour le grand public.
Beaucoup de gens sont responsables, à différentes échelles (mais pas échelles de QI 🙂)
J’aimeJ’aime
En relisant, je m’aperçois que je n’ai pas cité l’article !
J’ajoute cet extrait (qui peut être dans le florilège)
« »« Ils n’ont pas seulement une intelligence quantitative supérieure, explique Jeanne Siaud-Facchin, psychologue qui a suivi et étudié de nombreux surdoués. Ces petits zèbres, comme j’aime à les appeler, ont un raisonnement différent, qui mêle une intelligence qualitativement singulière et une émotionnalité tout aussi particulière. » »
https://www.magicmaman.com/je-suis-parent-a-haut-potentiel-intellectuel-comment-gerer,3679826.asp?fbclid=IwAR3QPwRN3eOuSLKWujFn5LEsVisG65b5CoOngrrQHKFK_mAKLYV92puE3ww
J’aimeJ’aime
J’ai assisté aujourd’hui à une journée-conférences de l’ANPEIP (association nationale pour les enfants intellectuellement précoces). Le matin une jeune femme se présentant comme « docteur en psychologie cognitive et clinicienne en psychologie du développement » nous explique doctement qu’on peut parler de HPI à partir de 120, que si on choisit 130 c’est parce qu’il y a moins de marge d’erreur. Au moment des questions, je fais remarquer à l’intervenante que le flyer de l’ANPEIP dit que la prévalence est de 2,3%, ce qui veut dire des personnes qui obtiennent un QI à au moins deux écarts-types au-dessus de la moyenne, et que quel que soit le résultat obtenu il y a toujours une marge d’erreur, pas moins à 130 qu’à 120. Elle me répond que les personnes « hors normes » sont celles qui ont un QI inférieur à 80 ou supérieur à 119 et cite les noms de Jacques Lautrey et Todd Lubart pour appuyer son propos. Le premier est connu pour être très sceptique sur la notion de QI, le second a plutôt travaillé sur la créativité pour dire notamment qu’elle était peu corrélée à l’efficience intellectuelle. Donc je ne vois pas le rapport. Je lui dis que la normalité se définit pour le WISC en termes d’écart-types à la moyenne. Elle me répond que ça n’a rien à voir et passe à la question suivante.
L’après-midi, Fanny Nusbaum (docteur en psychologie, sophrologue, hypnothérapeute, thérapeute familiale et chercheur associé en psychologie et neurosciences à l’Université Lyon II et au CHU de Lyon) et Dominic Sappey-Marinier (biophysicien, chef du département IRM au CERMEP-Imagerie du Vivant à Lyon et enseignant-chercheur à la faculté de médecine Lyon-Est de l’Université Claude Bernard-Lyon I), sont venus présentés leur ouvrage écrit avec Olivier Revol (neuropsychiatre, pédopsychiatre, chef du Centre des troubles des apprentissages à l’hôpital neurologique de Lyon) : Les Philo-cognitifs : ils n’aiment que penser et penser autrement… à partir d’une étude qui a mis 10 ans à aboutir. Ces auteurs ont choisi de rebaptiser ce qu’on appelle « HPI » ou « surdouance », ou « précocité intellectuelle » ou « zèbre » etc. par le terme « philocognition » car cela correspond mieux selon eux à la réalité. Au cours de son intervention, M. Sappey-Marinier finit de répondre à ma question du matin sur un ton d’autorité en me disant que le QI n’est qu’une moyenne et qu’il suffit que l’indice verbal ou l’indice de raisonnement soit à 130 pour pouvoir parler de philocognition (en faisant référence au WISC-4). Il n’y a pas de question prévue alors, donc je ne peux pas répondre. Ce monsieur est certainement très compétent dans son domaine, mais en matière de psychométrie je préfère me fier à Jacques Grégoire. Or, ce dernier dit clairement que l’indice le plus corrélé au facteur G, c’est le QI et non l’ICV ou l’IRP.
Par ailleurs, les auteurs, à l’appui de nombreux exemples d’imagerie cérébrale, définissent un fonctionnement différent des philocognitifs avec deux sous-types identifiés : les « Complexes » et les « Laminaires » en référence à la mécanique des fluides qui oppose écoulement unidirectionnel (laminaire) à écoulement multidirectionnel (« turbulent » rebaptisé « complexe »). Les philocognitifs se définissent selon les auteurs par une connectivité plus élevée dans trois réseaux cérébraux : réseau exécutif (intentionnel), réseau par défaut (automatique) et réseau de saillance (qui modulerait les deux précédents). Ils parlent respectivement d’hyperspéculation, d’hyperlatence et d’hyperacuité.
Dans leur étude, ils ont utilisé le WISC-4 et ont défini ainsi les deux profils sur le plan opératoire :
– Les philo-laminaires ont une différence ICV-IRP inférieure à 15
– Les philo-complexes ont une différence ICV-IRP supérieure à 15
Je ne sais pas dans quelle mesure l’imagerie médicale valide ce choix opératoire.
Tout cela a l’air très intéressant mais conforte le public de l’ANPEIP dans l’idée que les philocognitifs ont un fonctionnement cognitif qualitativement différent, idée qui leur tient particulièrement à cœur. Or, on peut penser que l’intensité de la connectivité s’intensifie à mesure que l’on monte dans l’échelle de QI sans pour autant qu’il y ait un saut qualitatif au passage d’un seuil déterminé.
Enfin, il y aurait des traits de personnalité attachés à chaque sous-type. Les philo-complexes sont des généralistes, les philo-laminaires sont des spécialistes. Les PC ont une bonne estime de soi en général mais manque de confiance en eux car ils doivent tout au long de leur vie lutter pour faire leur place. Les philo-laminaires c’est le contraire. Le PC est plus dans la sympathie alors que le PL est plus dans l’empathie. Les PC utiliseraient plus l’hémisphère gauche et les PL le droit etc. On donne des exemples de personnalités PC (W. Churchill, C. Chaplin, A. Rimbaud, A. Winehouse, Madona, A. Finkielkraut, A. Einstein, P. Doherty), et de personnalités PL (Astérix (sic), V. Hugo, C. Chazal, S. Veil, C. de Gaulle, R. Federer, J. d’Ormesson).
Bref, M. RAMUS, quelle valeur scientifique peut-on accorder à ce nouveau chapitre de la littérature sur le sujet ?
J’aimeJ’aime
Merci pour ce compte-rendu. J’ai cherché s’il y avait de nouvelles publications scientifiques de ces auteurs. J’en ai trouvé deux:
Kocevar, G., Suprano, I., Stamile, C., Hannoun, S., Fourneret, P., Revol, O., … Sappey-Marinier, D. (2019). Brain structural connectivity correlates with fluid intelligence in children: A DTI graph analysis. Intelligence, 72, 67–75. https://doi.org/10.1016/j.intell.2018.12.003
Suprano, I., Delon-Martin, C., Kocevar, G., Stamile, C., Hannoun, S., Achard, S., … Sappey-Marinier, D. (2019). Topological Modification of Brain Networks Organization in Children With High Intelligence Quotient: A Resting-State fMRI Study. Frontiers in Human Neuroscience, 13. https://doi.org/10.3389/fnhum.2019.00241
Le premier article étudie des corrélats neuroanatomiques de l’intelligence générale. Seul le second parle spécifiquement des enfants HQI, sur la base de la même population que l’article précédent (Nusbaum et al. 2017, que je cite dans l’article ci-dessus).
Dans ce second article, ils comparent cette fois des indicateurs de connectivité fonctionnelle entre les différents groupes d’enfants. Les données sont nouvelles, mais je ne vois rien qui contredise mes conclusions précédentes. En particulier, on peut se convaincre en regardant leurs multiples figures qu’il n’y a aucune discontinuité dans les indicateurs qui diffèrent entre HQI et QI normaux.
En regardant de plus près les données rapportées, on repère quelques détails troublants. Dans la partie Méthodes, il est indiqué « Children with a HIQ (IQ > 130) were labeled as HIQ children and two HIQ profiles were defined based on score difference between VCI and PRI » (contrairement à la publication précédente, qui disait qu’il suffisait que le seuil de 130 soit dépassé soit par le VCI, soit par le PRI). Pourtant les résultats rapportés dans le Tableau 1 contredisent cela: le groupe de HQI a un QI moyen de 134 avec un écart-type de 12. Et les HQI hétérogènes ont un QI moyen de 129, autrement dit la plupart ne sont pas HQI!
Les figures 2 à 6 de l’article confirment cela: les « HQI hétérogènes » ont des QI allant de 110 à 150, avec une bonne moitié en-dessous de 130. Même les HQI homogènes ne sont pas tous au-dessus de 130: on en voit deux entre 120 et 125.
Bref, les critères d’inclusion spécifiés dans les méthodes ne sont pas respectés, et le groupe labellisé « HQI hétérogène » n’est en majorité pas HQI. Ces incohérences auraient dû être dépistées par les relecteurs.
Du coup, comme je l’avais déjà souligné, la comparaison des deux profils de HQI est confondue avec une différence de 12 points de QIT en moyenne. Les auteurs défendent une définition non standard du haut QI. Et rien n’établit la validité des deux profils, qui n’émergent pas clairement des données, mais qui sont définis a priori.
J’aimeJ’aime
Merci beaucoup pour votre point de vue d’expert !
J’aimeJ’aime
Merci M. Ramus pour cet article.
Dans votre analyse des travaux mentionnés dans le précédent commentaire, vous citez la méthodologie qui précise « Children with a HIQ (IQ > 130) were labeled as HIQ children and two HIQ profiles were defined based on score difference between VCI and PRI », et vous indiquez que cette labellisation contredit l’autre étude qui classe comme HQI les enfants dont seul un des deux indices est supérieur à 130.
En première lecture, pour moi le sens de la méthode de la deuxième étude est une distinction selon l’écart de résultats entre VCI et PRI, et pas une distinction entre HQI et non HQI selon les résultats de l’un de ces deux indices.
On peut donc définir un groupe d’enfants HQI sur le fait qu’un des deux indices seulement est supérieur à 130 (étude 1) et ensuite faire 2 sous-groupe en fonction de l’écart entre les 2 indices : un sous-groupe pour ceux dont l’écart entre les indices est inférieur ou supérieur à X. Avec cette interprétation de la méthode, il n’y a pas contradiction entre les études.
Cela ne remet pas en question le fait que l’établissement du caractère HQI ou non par cette étude diffère de la méthode communément admise ! Cependant, il me semble qu’un des objectifs qui sous-tend ces études est de montrer que, au-delà d’une classification fondée uniquement sur un facteur, des différences peuvent exister dans des écarts plus ou moins importants entre plusieurs indices. Il me semble donc recevable que ces études explorent d’autres méthodologie de classement que celles communément admises, puisqu’elles cherchent à les questionner…
J’aimeJ’aime
Il y avait lors de cette journée une inspectrice de l’éducation nationale qui s’est présentée comme « référente EIP » sur le département. Cette personne s’est dite enchantée de sa journée. Elle n’a eu aucune remarque, question, qui aurait pu exprimer ne serait-ce qu’un début de distance critique sur au moins un des points abordés pendant les conférences. Idem pour le public présent composé essentiellement de parents et d’enseignants. Pourtant la définition du HQI par les auteurs et la prévalence affichée (2,3%) aurait dû questionner cette inspectrice en tant que personne-ressource sur le sujet. L’éducation nationale, censée être l’institution du savoir, semble beaucoup s’appuyer sur des associations de parents d’enfants HQI, ou supposés l’être, alors que ces associations ne sont pas des instances scientifiques.
D’où ma question : l’éducation nationale étant maintenant dotée d’un conseil scientifique, est-ce que des référents HQI de l’EN ne devraient pas se tourner vers le CSEN plutôt que vers des associations de parents comme l’ANPEIP ?
J’aimeJ’aime
Ca semblerait logique, n’est-ce-pas? Le problème c’est qu’il y a à l’Education Nationale de nombreuses personnes qui se considèrent expertes d’un sujet, ou qui croient en connaître les experts. Ces personnes n’ont généralement pas l’idée qu’un regard scientifique indépendant (venant par exemple du CSEN, ou d’experts identifiés par le CSEN) pourrait apporter quelque chose d’utile. De ce fait, beaucoup de choses sont faites sans que le CSEN soit jamais consulté. On l’a vu pour le vademecum sur les EIP, tout comme celui sur les troubles psychiques.
J’aimeJ’aime
PsyEN vos commentaires sont remarquables. Nusbaum a qui j’ai posé la question sur les philocognitifs (ridicule cette terminologie) en quoi pensent ils différemment en faisant référence à l’article de F-Ramus? Réponse elle m’a bloquée et ne parle qu’avec les gens qui flattent sont pseudo travail ( tout flatteur vit aux dépens de celui qui l’écoute ) . D’ailleurs la psy qui m’a testée travaille avec cette bande et me parle de profil complexe. Avec un QI supérieur à 130 j’ai surtout compris mon hétérogénéité grâce à l’article de Grégoire et Labouret, de plus ayant déjà un stress bloquant elle ne m’a pas mise en confiance du tout. J’ai du lui donner les références sérieuses sur le sujet Ramus,Gauvrit,Grégoire,Labouret,Whal car elle n’y connaissais rien et se dit spécialiste des HPI. Comment expliquez vous que de ma place ( je n’ai pas fait d’étude de psychologie juste passionnée) j’en sache plus qu’une soit disant professionnelle? Ce sujet du HPI en France est infecté par le virus du fric et de la bêtise dont les média grand plubic sont le meilleur allié.
J’aimeJ’aime
Il y a quelque chose qui m’a toujours beaucoup interrogé et qui est, je crois, passé sous silence dans les 2 études de l’équipe Lyonnaise (et ma question n’a bien sûr pas obtenu de réponse lors de la table ronde du mercredi soir 29/04/2020): ils parlent de l’hétérogénéité dans son sens large et puis ils mentionnent ensuite que les het-HQI ont un ICV>>IRP (les 3 sujets sur 27 qui avaient un IRP>> ICV ont donc été virés, ce qui fait sens mais qui n’est pas discuté cependant…).
Je peux aisément imaginer qu’ils aient davantage cette population que des IRP>>ICV car j’ai l’impression que c’est le profil majoritairement retrouvé chez les personnes ayant été dépistées HPI. Cependant cela interroge car dans le manuel d’interprétation et de cotation de la WAIS (je n’ai que celui de la WAIS mais je suppose que cela est assez similaire dans le WISC), lorsqu’on regarde le taux observé dans la population d’étalonnage de ICV>> IRP, il est à peu près similaire à la configuration inverse (néanmoins variable en fonction du QIT, mais bizarrement, plutôt dans le sens où ICV>IRP est surreprésentée et est la seule à être l’objet d’étude dans les 2 études de cette équipe?
Au final, nous pouvons nous demander si ce profil peut vraiment être assimilé au HPI (lorsque le QIP est plutôt autour de 115 et qu’il n’existe pas de trouble spécifique expliquant cela)… En effet, le QIV est assimilé à l’intelligence cristallisée et donc à l’intelligence plutôt acquise (et donc aux apprentissages; qui ne sont d’ailleurs pas nécessairement scolaires bien sûr). Est-ce que le profil décrit dans leur étude (et tant médiatisé…) ne serait pas un profil de personnes certes intelligentes mais ayant surtout bien investi la sphère verbale?
Cela pourrait peut être expliquer aussi qu’on les retrouve davantage dans la population clinique: personnes beaucoup dans l’introspection, se posant beaucoup de questions etc).
Une autre hypothèse de la sur-représentation de ce profil dans la population clinique serait une mauvais cotation des tests par les psys? Je suis neuropsychologue et doctorante en psychologie et j’ai donc bien connaissance de ces tests (et aussi de certaines pratiques). S’il est clair que les parties IRP, IMT et IVT ne peuvent être soumises à interprétation, il n’en est pas de même pour la partie ICV. C’est d’ailleurs quelque chose que nous avions constaté lors de l’apprentissage de la passation de ces tests en master: en cotant tous les mêmes réponses, la notation pouvaient être variables (même si les tests sont censé avoir une bonne fidélité inter-juge). Je le constate en enseignant moi même la psychométrie maintenant (les cotations de mes étudiants sont parfois assez libertaires…) Même si l’attribution des points est précise, les participants disent rarement exactement ce qui est écrit dans le matériel de cotation et il y a toujours une part d’interprétation. Si l’on considère par ailleurs que beaucoup de psychologues font passer ces tests sans réelle formation (ou avec une mauvaise formation), je soupçonne que cet indice puisse être sur-évalué dans bien des cas.
Je serai intéressée pour avoir votre avis sur les problématiques que j’évoque.
J’aimeJ’aime
Bonjour Monsieur Ramus, je vous ai antérieurement contacté avec une interrogation en tant que maman d’un ado et vous aviez eu l’extreme gentillesse de me répondre. A la lecture de votre article et de ce que j’ai pu en comprendre à mon niveau, je me permets de reposer ici mon questionnement en lien concernant donc mon fils ayant un profil hpi assez homogène, un tdah de type innatention & une dysgraphie importante. Une corrélation est-elle plausible entre la présence de larges fibres à myéline visibles de manière totalement inattendue dans la rétine lors d’un examen ophtalmologique approfondi, un OCT, et un profil cognitif de près de 4 écarts types lors d’un bilan wisc 4 si on peut constater la spécificité des gaines de myéline chez les sujets à haut qi? Si des personnes ici avaient des retours d’expérience ce serait avec grand intérêt et plaisir de vous lire. Merci beaucoup par avance de permettre cette question assez spécifique. Bien cordialement.
J’aimeJ’aime